Gesundheit und Erkrankungen
Erkrankungen des Bewegungsapparats
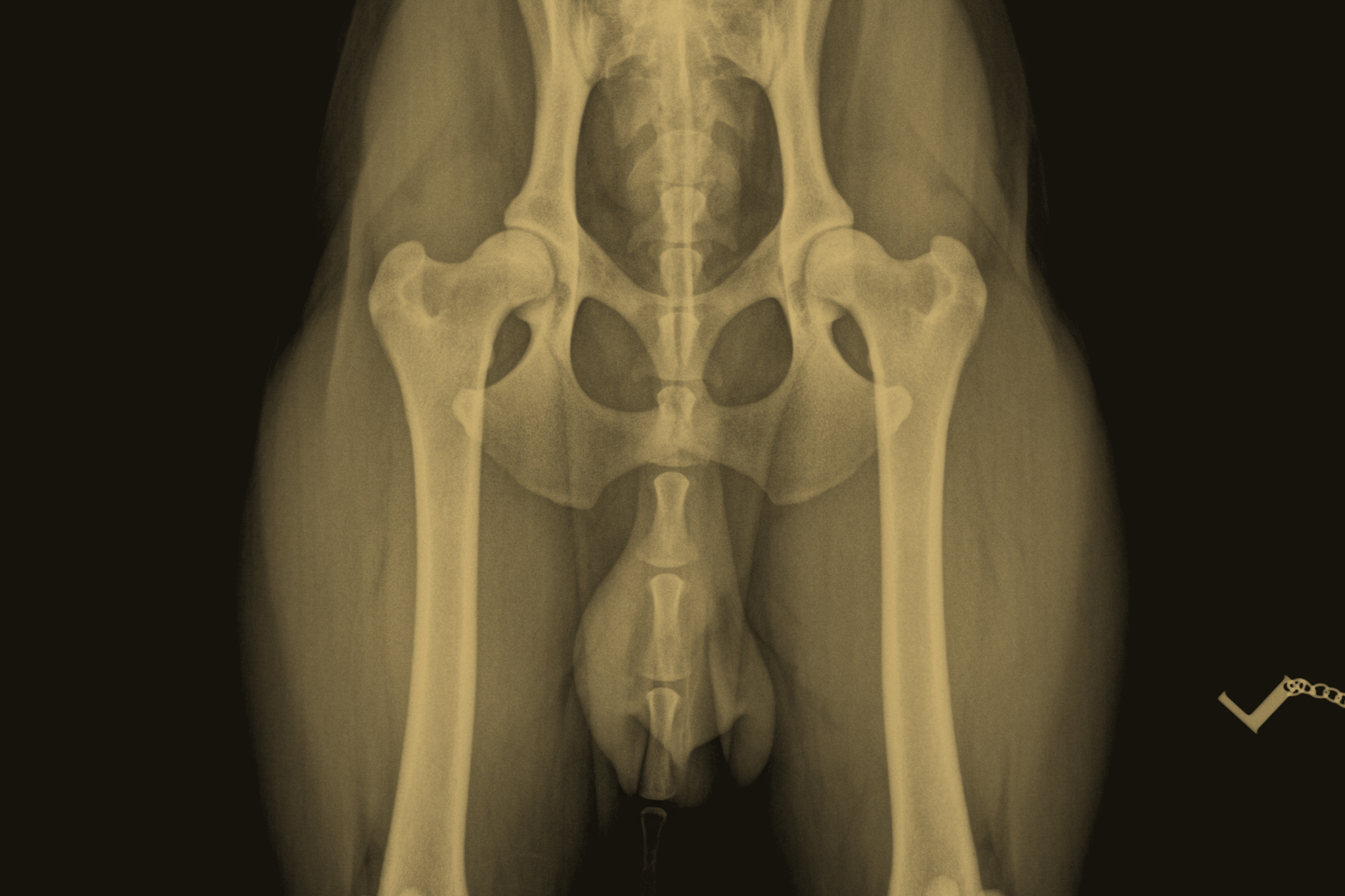
Hüftgelenksdysplasie | HD
Die Hüftgelenksdysplasie des Hundes ist eine zumeist erblich bedingte Fehlbildung, bei der die Hüftgelenkspfanne dem Kopf des Oberschenkelknochens nicht genügend Halt bietet. Der Grad der Ausprägung kann darüber hinaus aber auch durch äußere Faktoren, wie Bewegung und Fütterung, beeinflusst werden. Die Krankheit äußert sich mit zunehmenden Bewegungsstörungen (z. B. einem unsicheren, schwankendem Gang) bis hin zu einer hochgradigen Lahmheit der Hinterhand. Der Verlauf der Erkrankung hängt in erster Linie von der Schwere der Gelenkveränderungen und der Beanspruchung des erkrankten Gelenks durch Bewegung und Gewicht ab. Außerdem können Alter, Größe und die Bemuskelung der Hinterhand den Krankheitsverlauf deutlich beeinflussen.
Durch Röntgendiagnostik und die anschließende Auswertung (Winkelmessung) eines Gutachters wird der Grad der Erkrankung festgestellt und eingeteilt. Das Klassifizierungsschema des FCI sieht dabei vor:
HD-A – Frei von Hüftgelenksdysplasie
HD-B – Verdacht auf Hüftgelenksdysplasie
HD-C – Leichte Hüftgelenksdysplasie
HD-D – mittlere Hüftgelenksdysplasie
HD-E – schwere Hüftgelenksdysplasie
Hunde, die mit einer leichten Hüftgelenksdysplasie ausgewertet worden sind, können – bei sehr guter Bemuskelung – zwar noch aktiv Hundesport betreiben, sind aber nach der Zuchtordnung des Club für britische Hütehunde von der Zucht ausgeschlossen. Eine Zuchtzulassung wird ausschließlich Tieren der HD-Grade A und B erteilt.
Stoffwechselerkrankungen
Ceroid Lipofuscinosis | CL
CL ist eine seltene erbliche Stoffwechselfunktionsstörung mit tödlichem Verlauf. Bei erkrankten Tieren findet bereits ab dem Embryonalstadium statt des Abbaus eine Einlagerung des Zellabfallprodukts »Ceroid Lipofuscin« in den Gewebezellen statt. Ab einem Alter von 18 Monaten beginnen diese Zellabfälle aufgrund der geringen Kapazitäten zur Einlagerung im Gehirn auf das gesunde Hirngewebe zu drücken und dieses zu zerstören – plötzlich auftretende gesteigerte Unsicherheit, Desorientierung, Hyperaktivität und eine Veränderung der normalen Bewegungsabläufe können u. a. die Folge sein.
Anhand eines Gentests kann das für die Erkrankung verantwortliche Gen bestimmt werden. Träger des Gens werden nicht zur Zucht eingesetzt.
Autoimmunerkrankungen
Trapped Neutrophil Syndrome | TNS
Das »Trapped Neutrophil Syndrome« ist eine autosomal-rezessiv vererbte Erkrankung, bei der das Knochenmark zwar Neutropile (weiße Blutkörperchen) produziert, diese aber nicht effektiv in den Blutkreislauf abgeben kann. Mögliche Infektionen können durch die deutliche Beeinträchtigung des Immunsystems nicht bekämpft werden und führen in der Folge immer zum Tod.
Ein Großteil der Welpen erkrankt innerhalb der ersten Lebenswochen, in seltenen Fällen später. Die meisten betroffenen Welpen sterben letztendlich an einer Infektion oder werden innerhalb der ersten vier Lebensmonate eingeschläfert. Die Tatsache, dass das Blutbild zum einen nicht immer einen zu niedrigen Wert weißer Blutkörperchen anzeigen muss und sich zum anderen, bedingt durch die Vielzahl möglicher Infektionen, keine eindeutigen Symptome zuordnen lassen, erschwert die Diagnose – weshalb viele Krankheitsfälle gar nicht erst erkannt werden.
Mittels eines Bluttests ist es möglich eine Trägerschaft der TNS-Mutation festzustellen. Ein Träger darf niemals mit einem anderen Träger verpaart werden.
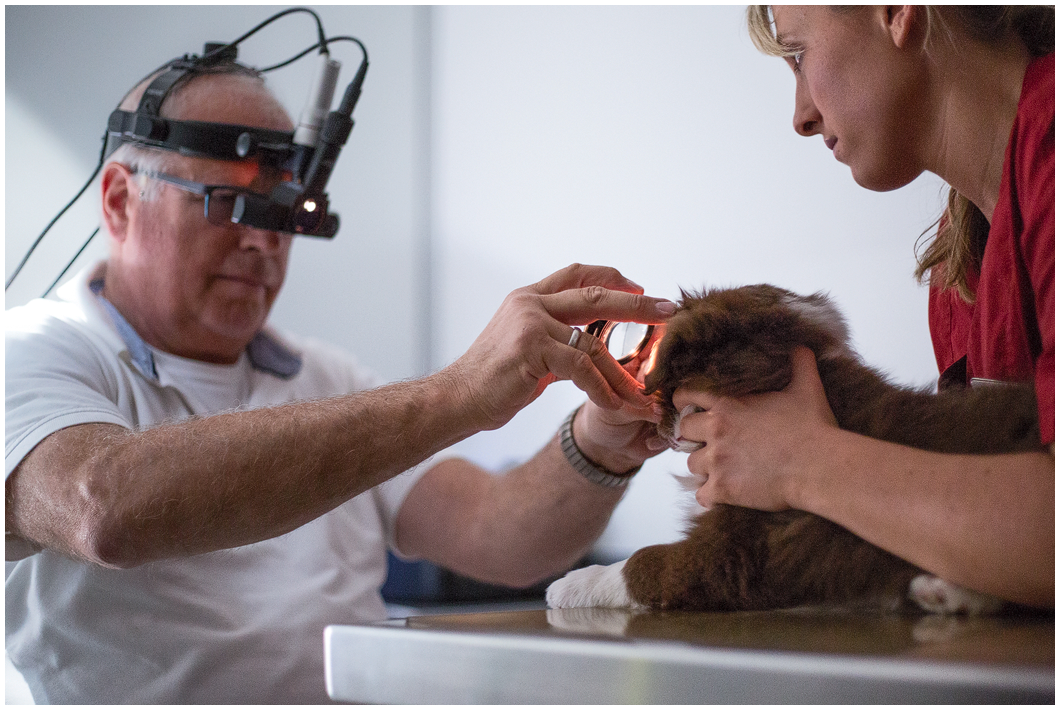
Erbliche Augenerkrankungen
Collie Eye Anomaly | CEA
Bei der Collie Eye Anomaly handelt es sich um eine erbliche Augenerkrankung, die durch einen Defekt im Augenhintergrund verursacht wird. Befallene Hunde weisen Veränderungen der Netzhaut im Auge auf – von leichten Fehlstellen bis hin zur vollständigen Ablösung der Netzhaut, die eine völlige Erblindung des betroffenen Hundes bedeutet.
Da der Erbgang der für die Erkrankung verantwortlichen Gene autosomal-rezessiv verläuft – das für den Befall verantwortliche Gen verhält sich rezessiv gegenüber dem dominanten Gen zur normalen Ausprägung des Augenhintergrunds – kann der Defekt nur dann auftreten, wenn zwei Träger des rezessiven Gens (CEA-Carrier) verpaart werden.
Ein Gentest wurde erstmals 2004 durch das Labor Optigen in den USA angeboten, hat sich in der Zwischenzeit auch in vielen in Europa ansässigen Laboren etabliert.
Progressive Retina Atrophie | PRA
Die progressive Retina Atrophie ist ein erbliches Augenleiden, das mit einer fortschreitenden Zerstörung der Sehzellen und anderer Elemente der Netzhaut einhergeht und im Endstadium immer zur vollständigen Erblindung des Hundes führt. Wie auch CEA wird die progressive Retina Atrophie von beiden Elterntieren rezessiv vererbt, das heißt, zum Befall kann es nur bei einer bereits vorhandenen Trägerschaft beider Elterntiere kommen. Erste Krankheitssymptome können Nachtblindheit und eine Einschränkung des Sehvermögens bei Dämmerlicht sein, im weiteren Verlauf der Erkrankung machen sich diese Einschränkungen auch bei Tageslicht bemerkbar.
Grauer Star | Katarakt
Als Katarakt wird, unabhängig von der Ursache oder dem Zeitpunkt des Auftretens, jede Trübung der Augenlinse oder der Linsenkapsel bezeichnet. Sofern nicht Hinweise auf physiologische Ursachen (Stoffwechselstörungen, wie z. B. Diabetes mellitus) oder Traumata deuten, wird die Erkrankung als erblich angesehen.
Grüner Star | Glaukom
Durch einen zu engen Kammerwinkel und zu hohen Augeninnendruck kommt es bei einer Glaukomerkrankung zu einer schmerzhaften Vergrößerung und Trübung des Augapfels, die in der Regel zur Erblindung führt. Unter Umständen ist sogar eine Entfernung des betroffenen Auges notwendig. Der Erbgang der Erkrankung ist zwar noch nicht bekannt, eine ophthalmologische Untersuchung des Kammerwinkels kann jedoch bereits bei jungen Hunden durchgeführt werden, um eine mögliche Veranlagung zu erkennen oder auszuschließen.
CEA, PRA und Katarakt können nur von einem speziell dafür ausgebildeten und ausgerüsteten Facharzt (DOK) erkannt und ausgeschlossen werden. Routinemäßig ist diese Augenuntersuchung für den Border Collie vor der 2. Wurfabnahme durch den Zuchtwart in der 6. bis 9. Lebenswoche vorgesehen (bei Welpen deren Elterntiere nachweislich beide genetisch CEA-Normal getestet worden sind, kann diese Untersuchung entfallen).
Andere Erkrankungen/Defekte
Multi Drug Resistance | MDR1
MDR1 ist ein Transportsystem, welches im Organismus an der Verteilung und Ausscheidung von vielen Arzneistoffen beteiligt ist. Das Fehlen von MDR1 bei Hunden mit vorhandenem MDR1-Gendefekt (MDR1 -/-) führt zu einer Überempfindlichkeit gegenüber manchen Arzneistoffen (z. B. Ivermectin), die ungehindert die Blut-Hirn-Schranke passieren und in das Gehirn eindringen können. Neben neurotoxischen Symptomen kann es bei hohen Konzentrationen zu gravierenden Nebenwirkungen kommen, welche nicht selten den Tod des betroffenen Hundes bedeuten. Wie bei anderen Erbkrankheiten des Hundes handelt es sich auch hier um einen autosomal-rezessiven Erbgang, weshalb niemals ein Träger mit einem anderen Träger verpaart werden sollte. Der MDR-1-Defekt kann mittels eine DNA-Tests untersucht und zuverlässig nachgewiesen werden.
Imerslund-Gräsbeck Syndrom | IGS
Das Imerslund-Gräsbeck Syndrom ist eine rezessiv vererbte Cobalamin-Resorptionsstörung, die neben anderen Rassen auch den Border Collie betrifft. Cobalamin (Cbl) kann dabei nicht oder nicht ausreichend selbst produziert oder aus der Nahrung entnommen werden, ein absoluter Mangel an Vitamin B12 ist die Folge. IGS wird autosomal rezessiv vererbt. Das bedeutet, dass beide Eltern Träger sein müssen, um einen befallenen Welpen zu produzieren.
Während Welpen zwar mit einer Colabamin-Reserve geboren werden und es in den ersten Lebenswochen kaum Auffälligkeiten gibt, ist diese Reserve jedoch schnell verbraucht, wenn neues Colabamin nicht aus der Nahrung gewonnen werden kann, so dass sich die ersten klinischen Symptome bereits in der sechsten bis zwölften Lebenswoche bemerkbar machen. Beim Border Collie konnte darüber hinaus ein später einsetzender Krankheitsverlauf beobachtet werden, bei dem erste Symptome (bspw. Appetitlosigkeit, Wachstumsretardierung und krankhafte Abmagerung) erst in einem Alter zwischen 8 und 42 Monaten auftreten. In Abstimmung mit dem Tierarzt können betroffene Hunde erfolgreich substituiert und therapiert werden.
Die Vererbung erfolgt autosomal rezessiv. Eine Trägerschaft ist mittels eines entsprechenden Gentest nachzuweisen.
Epilepsie beim Border Collie
Definition
Epilepsie (abgeleitet vom griechischen επιληψης: der Anfall, der Übergriff) ist die häufigste chronische neurologische Erkrankung beim Hund. Etwa zwei Prozent aller Rassehunde erleiden im Laufe ihres Lebens einen epileptiformen Anfall – die meisten Hunde zwischen ihrem ersten und fünften Lebensjahr. Als epileptischer Anfall wird eine plötzliche Entladung der Nervenzellen im Gehirn bezeichnet, die ein oder mehrere Hirnareale betreffen und je nach Lokalisation zu unkontrollierter Muskelaktivität einzelner Körperteile bis hin zu schweren, den gesamten Muskeltonus betreffenden Krämpfen führen kann. Der Verdacht auf eine krankhafte Form der Epilepsie wird durch mindestens zwei spontan aufgetretene Krampfanfälle definiert.
Das gesamte Hirn des Hundes ist betroffen. Es kommt zu einer plötzlichen Versteifung des ganzen Körpers, sich wiederholende, rhythmische Krämpfe in den Extremitäten können beobachtet werden. Ferner sind ein Verdrehen der Augen, Bellen und Speicheln typisch, auch kann es zum Abgang von Kot und Urin kommen.
Das Bewusstsein des Hundes ist eingetrübt.
In der Post-Ictalen-Phase (nach dem Anfall) wirkt der Hund oftmals erschöpft und desorientiert, ist schwer oder gar nicht ansprechbar, oftmals macht sich auch ein abnormes Hungergefühl bemerkbar.
Nur ein Teil des Hirns des Hundes ist betroffen. Es kommt u. a. zu einseitigen Krämpfen, dem Zucken einzelner Gliedmaßen oder der beständigen Wiederholung bestimmter Bewegungen.
Der Hund ist in der Regel bei Bewusstsein.
Eine Post-Ictale-Phase (nach dem Anfall) bleibt aus.
Von Serien- oder Cluster-Anfällen spricht man bei zwei oder mehr Anfällen innerhalb von 24 Stunden.
Der lebensbedrohliche Status epilepticus ist durch eine Anfallsdauer von länger als fünf Minuten oder mehrere, so schnell aufeinanderfolgende Cluster-Anfälle gekennzeichnet, dass der Hund zwischen den Anfällen nicht mehr das volle Bewusstsein erlangt.
Ideopathische und symptomatische Epilepsie
Abhängig von der Ursache der Anfälle werden zwei Ausprägungen unterschieden: die ideopathische (primäre) und die symptomatische (sekundäre) Epilepsie. Während bei der symptomatischen Epilepsie angeborene oder erworbene strukturelle Veränderungen des Gehirns (beispielsweise als Folgen von Entzündungen, Traumata oder Neoplasien) zugrundeliegen, können bei der ideopathischen Epilepsie weder durch klinische, noch durch neurologische Untersuchungen anderweitige Befunde erhoben werden.
Die ideopathische Epilepsie tritt bei fast allen Hunderassen auf. Eine erbliche Disposition wird insbesondere für den Border Collie angenommen, bei dem man aufgrund der hohen Prävalenz derzeit davon ausgeht, dass etwa 15 Prozent der Gesamtpopulation als Merkmalsträger betroffen sind. Vermutet wird, dass es sich um einen komplexen, polygenen Erbgang handelt, bei dem Mutationen an vielen Genorten auftreten.
Diagnostik
Aufgrund der komplexen Genetik der Erkrankung konnte bis zum heutigen Tag kein Testverfahren gefunden werden, das es ermöglichen würde, Merkmalsträger und betroffene Hunde eindeutig zu identifizieren. Da auch diverse andere Erkrankungen mit epileptiformen Anfällen einhergehen, sollte deshalb im Verdachtsfall immer eine sorgfältige Ausschlussdiagnostik vorgenommen werden, die neben hämatologischen und biochemischen auch kardiologische und neurologische Untersuchungen sowie eine möglichst gründliche (Familien-)Anamnese beinhaltet.
Therapie
Ein therapeutischer Erfolg – das heißt, die Minderung der Anfallshäufigkeit, -schwere und -dauer – ist nur durch eine medikamentöse Langzeittherapie zu erreichen, die individuell auf den Hund abgestimmt und regemäßig kontrolliert werden muss. Für die Dauertherapie haben sich vor allen Dingen Phenobarbital (bspw. Luminal), Kaliumbromid (bspw. Dibro-Be) und Primidon bewährt, die neben einem monotherapeutischen Einsatz auch ergänzend im Zuge einer Kombinationstherapie eingesetzt werden. Einschränkungen der Lebensqualität durch etwaige Nebenwirkungen der Antiepileptika sollten dabei möglichst gering gehalten werden. Eine Therapieresistenz wird insbesondere für den Border Collie angegeben, bei dem etwa bei einem Fünftel der epileptischen Hunde kein therapeutischer Erfolg erzielt werden kann.
Zucht
An Epilepsie erkrankte Hunde sind von der Zucht ausgeschlossen. Bei Eltern und Wurfgeschwistern sollte aus ethischen Gründen ebenfalls ein Zuchtausschluss angeraten sein, da eine mögliche Trägerschaft und Vererbung nicht ausgeschlossen werden kann.
Da uns für die Zucht bis auf weiteres kein entsprechender Gentest zur Verfügung steht und wir zur Risikovermeidung somit auf breite Kenntnisse angewiesen sind, sollten bekannte Krankheitsfälle öffentlich gemacht und in entsprechende Datenbanken eingetragen werden.
Tschechische Epilepsie-Datenbank
Britische Epilepsie-Datenbank
